

2025-03-31
心血管疾病是美国首要的死亡原因,先天性心肌病占出生缺陷的很大一部分,这凸显了开发新型心脏组织模型以发展新疗法的未满足需求。
动物模型和二维细胞培养最常用于模拟心血管疾病以及评估心脏对药物的反应和新药的心脏毒性,然后才进行临床试验。然而,二维细胞培养缺乏原生组织的三维微结构以及细胞与细胞外基质环境之间的相互作用。特别是心脏的心肌层,这是在收缩期提供收缩强度的主要层,由高度排列的心肌细胞组成。心脏毒性通常在二维细胞培养中评估,这些培养方式不能很好地模拟这种原生的三维细胞微结构。因此,这些平面培养条件导致了非生理的排列和受损的细胞间通讯,这可能会产生严重误导的体外结果。另一方面,动物模型成本高昂,由于物种间器官功能的差异,其对人类器官药物反应的预测价值有限。根据美国食品药品监督管理局(FDA)的数据,大约 92% 在临床前动物测试中成功通过的药物在随后的人体试验中失败,这导致将一种新药成功推向市场的成本极高(约 10 亿至 20 亿美元)。此外,许多成功上市的药物主要由于药物诱导的心脏毒性而被撤回。另一个问题是,一些药物可能对某些基因型、种族、性别和年龄的人群产生不成比例的益处或伤害,这表明临床试验的结果可能是不同患者可变反应的有限代表。
人类诱导多能干细胞(iPSC)技术的进步激发了用于组织再生和药物代谢研究的患者特异性体外组织模型。
iPSC 可以从患者自身衍生,并且与人类原代心肌细胞相比具有更高的增殖能力,后者极难获得和维持。因此,iPSC 可以作为创建患者特异性组织模型的丰富细胞来源。此外,患者衍生的 iPSC 的多样性也可以通过考虑基因型、种族、性别和年龄等因素来增加不同组织模型的多样性,这些因素在药物开发中可能是重要的考虑因素。使用 iPSC 进行组织工程还可以避免与使用人类胚胎干细胞相关的伦理问题。尽管有关 iPSC 心脏分化的报告令人鼓舞,但仍存在挑战,以实现与成人细胞相当的成熟度或在生理相关的三维环境中体外成熟人类 iPSC 衍生的心肌细胞。
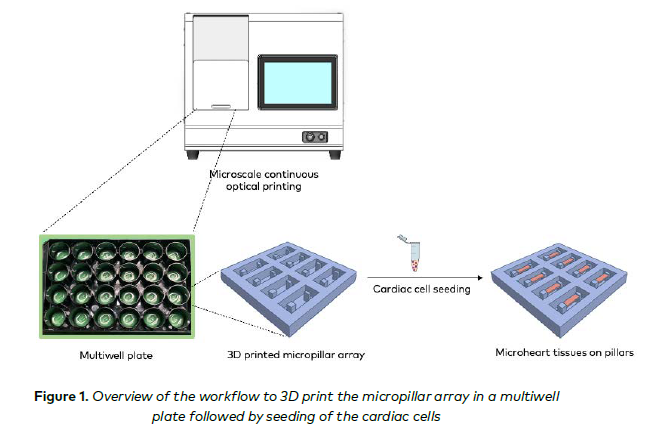
为应对这些挑战,我们利用我们专利的基于 DLP 的 3D 生物打印技术开发了一种人类微型心脏模型,以增强 iPSC衍生心脏组织的成熟度和机械刺激,用于高通量药物筛选、疾病建模和再生医学。 使用新型基于 DLP 的 3D 生物打印平台直接在标准多孔板中打印 3D 微柱阵列,随后播种人类 iPSC-CMs(图 1)。对 3D 打印微柱的机械性能进行了表征。通过改变柱间距离优化了微柱周围形成的心脏组织的肌节排列。还研究了 3D 培养和电刺激对心脏组织成熟度的影响。测量了对已知心血管药物(包括奥美沙坦美卡比利(OM)、左西孟旦(LEVO)和异丙肾上腺素(ISO))的心脏力产生,采用实时和非接触式方法。
材料和方法
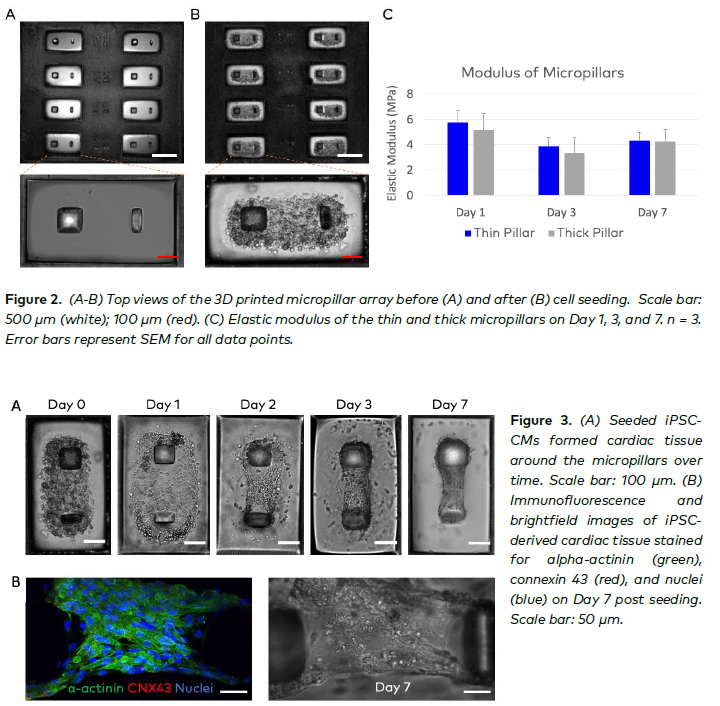
3D 生物打印微柱阵列 用于打印微柱的生物墨水包括 40%(体积比)聚乙二醇二丙烯酸酯(PEGDA,分子量 700,Sigma-Aldrich,455008)、0.2%(重量比)光引发剂锂苯基 - 2,4,6 - 三甲基苯甲酰基膦酸盐(LAP,Allegro 3D,M - 6000)、0.002%(重量比)4 - 羟基 - TEMPO(TEMPO,Sigma - Aldrich,176141)和 0.2%(重量比)2 - 羟基 - 4 - 甲氧基苯甲酮 - 5 - 磺酸(HMBS,Sigma - Aldrich,S454664)。自由基猝灭剂 TEMPO 首先溶解在乙醇中,制成 2% 的储备溶液,然后加入最终的生物墨水溶液中。生物墨水溶液超声处理 1 小时,以确保完全溶解。 微柱阵列直接在多孔板中使用基于 DLP 的 3D 生物打印系统(BIONOVA X,CELLINK)进行生物打印,以提供生物制造的打印分辨率、速度和可扩展性。为了提高通量,每个孔中同时打印了八对微柱。微柱阵列的数字掩模设计为提供厚柱与薄柱配对。两种柱的高度均设计为 500 微米。厚柱的截面尺寸为 135×135 微米,薄柱为 60×135 微米。利用 3D 生物打印机提供的高打印分辨率和灵活性,测试了各种柱间距离(即 100、150、175、200 和 225 微米),以优化心脏组织的肌节排列,以实现最大化的收缩力生成。
机械测试 柱的弹性模量是计算心脏组织对柱施加的弯曲力的关键参数。使用微尺度机械测试仪(Microsquisher,CellScale)在打印后第 1、3 和 7 天测试弹性模量,这些柱在 37 摄氏度和 5% 二氧化碳下在细胞培养基中孵育。简言之,使用金属梁在微心脏组织的高度处弯曲柱,达到 10% 的位移。在弯曲测试期间,Microsquisher 收集了弯曲力和位移数据,这些数据后来用于计算柱的弹性模量。
新生大鼠心室心肌细胞分离和培养 从 CD - 1 野生型小鼠(Charles River Labs)的新生大鼠中分离新生大鼠心室心肌细胞(NVCMs)。简言之,从 1 至 2 日龄的新生大鼠中收获心脏,并在 4 摄氏度下在含有 0.046%(重量比)胰蛋白酶(Affymetrix)的汉克斯平衡盐溶液(Gibco)中过夜消化。使用 II 型胶原酶(Worthington)通过在 37 摄氏度下摇晃 2 分钟去除心脏中的血细胞。进一步在 37 摄氏度下用 II 型胶原酶(Worthington)消化 7 分钟,得到包含心肌细胞和成纤维细胞的混合细胞群。通过将混合细胞在 T - 75 细胞培养瓶(Corning)上预培养 1.5 小时,在 37 摄氏度和 5% 二氧化碳下分离心肌细胞。然后将分离的心肌细胞以 1200 万 / 毫升的浓度重新悬浮在黑暗培养基中。黑暗培养基包括 75%(体积比)DMEM 和 25%(体积比)M199 培养基,含有 10 毫摩尔 HEPES、10%(体积比)马血清(hyclone)、5%(体积比)胎牛血清(Gibco)和 1%(体积比)100 倍青霉素 / 链霉素 / L - 谷氨酰胺溶液(Gibco)。
人类 iPSC 生成和心脏分化 使用先前发表的协议对人类 iPSC 进行重编程。简言之,人类围产期包皮成纤维细胞(BJ,ATCC)和人类成人皮肤成纤维细胞(HDF,Cell Applications)在 DMEM(Corning)中培养,补充有 10%(体积比)胎牛血清(Tissue Culture Biologicals)和抗生素 / 抗真菌剂(Corning),在 37 摄氏度和 5% 二氧化碳下进行。在重编程之前,将成纤维细胞以每孔 20 万细胞的密度播种在 6 孔板中。48 小时后,使用基于仙台病毒的 Cyto Tune 套件(Life technologies)按照制造商的协议开始重编程,以传递四个因子(即 Oct4、Sox2、Klf4 和 c - Myc)。随后挑选成功的克隆,并在无异种和饲养层的 Essential 8 培养基(Life Technologies)中维持在 hESC - 认证的 matrigel(Corning)上。 在分化之前,使用 Versene(Life Technologies)消化 iPSC,播种在涂有 matrigel 的 12 孔板中,并在 Essential 8 培养基中培养直至达到 80% 的汇合度。然后,使用 PSC 心肌细胞分化试剂盒(Life Technologies,A25042SA)开始心脏分化。iPSC 在 A 培养基和 B 培养基中依次培养 48 小时(总共 4 天)。之后,使用心肌细胞维持培养基再培养细胞 8 天。细胞在分化第 8 至 9 天开始自发跳动。在分化第 12 天,将细胞在无葡萄糖的 RPMI1640 培养基(Life Technologies)中纯化,补充有 4 毫摩尔乳酸(Wako Pure Chemical),再培养 6 至 7 天。然后将纯化的心肌细胞(即 iPSC - CMs)在 HEPES 缓冲的 RPMI1640 培养基(Life Technologies)中维持,补充有 2%(体积比)B27(Life Technologies),直到播种到 3D 打印的微柱结构中。为了准备播种,使用 0.25% 胰蛋白酶 - EDTA 处理 iPSC - CMs 5 至 7 分钟,然后以 200 g 离心 3 分钟以去除上清液。然后将细胞在 iPSC - CM 重悬培养基中重新悬浮,即 RPMI1640 培养基(Life Technologies)补充有 20%(体积比)胎牛血清(Gibco)和 5 微摩尔 ROCK 抑制剂 Y - 27632(STEMCELL Technologies)。细胞悬浮液保持在冰上,并立即用于播种。
细胞播种和维护 为了准备播种,将 3D 打印的微柱阵列结构储存在含有 1%(体积比)100 倍青霉素 / 链霉素 / L - 谷氨酰胺溶液(Gibco)的 DPBS 中,然后在生物安全柜中进行 1 小时紫外线照射。然后移除 DPBS 溶液,让 3D 结构在生物安全柜中风干。对于 NVCMs 的播种,将新鲜分离的 NVCM 悬浮液(1200 万 / 毫升)与预先冷却的基质混合物按 1:1 体积比混合,该混合物包含 3 毫克 / 毫升液体 pH 中性的大鼠尾胶原蛋白 I(Corning)和 1 毫克 / 毫升牛血浆纤维蛋白原(Sigma - Aldrich)。对于 iPSC - CMs 的播种,将新鲜收获的 iPSC - CM 悬浮液(1500 万 / 毫升)与预先冷却的基质混合物按 1:1 体积比混合,该混合物包含 2 毫克 / 毫升液体 pH 中性的大鼠尾胶原蛋白 I(Corning)和 1 毫克 / 毫升牛血浆纤维蛋白原(Sigma -Aldrich)。然后将混合的细胞 - 基质悬浮液添加到 3D 微柱阵列的顶部形成一个滴液。然后将多孔板以 200 g 离心 1 分钟,以促进细胞 - 基质混合物加载到微柱的微槽中。通过吸取移除 3D 结构周围的多余细胞 - 基质混合物,将多孔板在 37 摄氏度和 5% 二氧化碳的培养箱中孵育 30 分钟以聚合胶原蛋白。30 分钟孵育后,将 NVCM 黑色培养基或 iPSC - CM 重悬培养基添加到多孔板中,在 37 摄氏度和 5% 二氧化碳下培养样本,并且每天更换培养基。对于播种了 iPSC - CMs 的样本,在播种后第 2 天将 iPSC - CM 重悬培养基替换为补充有 2%(体积比)B27 的 RPMI1640 培养基,之后也是如此。对于电刺激,定制了铂电极以适应多孔板并附着在板盖上。从细胞播种后的第 4 天开始,每隔一天对样本进行 0.3 赫兹的电刺激。
免疫荧光染色和成像 在播种后第 3 天(对于 NVCM)或第 7 天(对于 iPSC - CM),将样本固定在 4%(重量比)多聚甲醛溶液(Wako)中,在室温下固定 15 分钟。然后将样本用 2%(重量比)牛血清白蛋白(BSA)(Gemini Bio - Products)溶液和 0.1%(体积比)Triton X - 100(Promega)在室温下封闭和通透化 1 小时。随后将样本在 4 摄氏度下与兔单克隆抗连接蛋白 43 抗体(1:100,Cell Signaling Technology)和小鼠单克隆抗 α - 肌动蛋白抗体(1:100,Sigma)一起孵育过夜。在主要抗体孵育后,将样本在室温下用 DPBS 洗涤三次,然后在室温下与荧光素偶联的抗 IgG 抗体(1:200,Biotium)一起孵育 1 小时。还添加了 Hoescht 33258(Invitrogen)核染色剂。在用 DPBS 洗涤三次后,将染色的样本储存在含有 0.05%(重量比)叠氮化钠(Alfa Aesar)的 DPBS 中,在 4 摄氏度下储存,并在 1 周内成像。使用 Leica DMI 6000B 显微镜(Leica Microsystems)和 Olympus FV1000 显微镜(Olympus America)获取明场和荧光图像。
RNA 分离和逆转录聚合酶链反应(RT - PCR) 为了准备 RNA 分离,将冰冷的 TRIzol 试剂(Ambion,Life Technologies)添加到样本中,并在移液 5 分钟后在 - 80 摄氏度下储存。为了收集足够的 RNA,将 4 至 8 个相同条件的组织样本汇集在一起。使用 Direct - zol RNA MiniPrep 套件(Zymo Research)按照制造商的协议从每个 TRIzol 样本中分离总 RNA。提取的 RNA 样本在 RT - PCR 实验之前储存在 - 80 摄氏度下。使用 PhotoScript®链 cDNA 合成套件(New England BioLabs)按照制造商的协议进行逆转录以合成 cDNA。使用 KAPA SYBR Fast qPCR 套件(KAPA Biosystems)、特定引物(Integrated DNA Technologies)和 StepOne™实时 PCR 系统(ThermoFisher)进行实时 RT - PCR。基于每个样本的阈值循环(Ct)进行相对定量。使用甘油醛 - 3 - 磷酸脱氢酶(GAPDH)作为管家基因来标准化数值。
药物孵育 在细胞播种后第 7 天,使用奥美沙坦美卡比利(OM,200 纳摩尔)、左西孟旦(LEVO,1 微摩尔)和异丙肾上腺素(ISO,100 纳摩尔)测试 iPSC-CM 组织样本对药物的反应。首先将样本在 Tyrode 溶液中孵育。在任何药物处理之前,记录由心脏组织收缩引起的细柱的位移作为配对对照。之后,样本在 Tyrode 溶液中分别用这三种药物在各自浓度下处理 5 分钟,然后记录并比较相同样本的细柱的位移与它们的配对对照。
位移测量和力计算 微柱对设计为一个粗柱和一个细柱。粗柱设计为在心脏组织收缩期间保持静止作为锚点,而细柱设计为对心脏组织收缩作出反应而弯曲。在光学显微镜下,使用 20×物镜聚焦在组织顶部,跟踪细柱的位移(w)。将柱位移数据导出并使用我们内部开发的定制代码进行分析。假设细的可弯曲柱可以被建模为一个矩形悬臂梁,一端固定,另一端自由,它在悬臂梁上某一点处受到收缩心脏组织施加的集中力(F)。悬臂梁的位移(w)可以作为从力点到固定端的距离(x)和相应的心脏组织产生的力(F)的函数来计算,即根据欧拉 - 伯努利梁理论推导出的方程(1)和(2)。方程中的其他参数包括惯性矩(I)、弹性模量(E)和从固定端到组织高度(a)。在这个特定应用中,组织高度(a)等于从力点到固定端的距离(x)。因此,组织弯曲柱产生位移(w)的力(F)可以使用方程(3)计算。
肌节长度和方向的定量分析 使用 ImageJ 中的线测量工具和方向性工具,在用 α - 肌动蛋白染色的心脏组织的共聚焦显微镜图像上测量肌节长度和方向。为了测量肌节长度,首先从线测量中生成 4 - 6 个肌节带的强度轮廓,使用相邻带之间的距离来计算平均肌节长度。为了测量肌节方向,生成并使用 ImageJ 中的方向性工具分析方向性轮廓。
统计分析 使用单因素方差分析(ANOVA)与 Tukey 事后检验比较具有 3 个或更多条件的样本群体。对于处理和未处理样本的配对比较,执行双尾配对 t 检验。在统计显著性分析中,以小于 0.05 的 p 值作为阈值。数据以平均值表示,误差条表示平均值的标准误差(SEM)。


Delivering Growth – in Asia and Beyond.